Pengertian Titrasi Nitrimetri, Prinsipnya dan Indikatornya
Pengertian Titrasi nitrimetri - Titrasi redoks banyak dipakai dalam pemeriksaan kimia hal tersebut dikarenakan berbagai macam zat organik maupun zat anorganik bisa ditentukan melalui cara ini. Salah satu metode yang termasuk titrasi redok yaitu titrasi Nitrimetri (diazotasi). Titrasi Nitrimetri sederhana dan sangat berguna sekali dalam menentukan kadar senyawa-senyawa anestetika lokal golongan asam amino benzoate dan juga senyawa-senyawa antibiotic sulfonamide. Tahukah kamu apa pengertian titrasi nitrimetri? Bagi kalian tentunya ada yang sudah tahu dan ada yang belum tahu. Bagi yang belum tahu di sini kami akan menjelaskan tentang definisi titrasi nitrimetri. Penjelasan ini tidak hanya membahas pengertian Titrasi Nitrimetri saja tetapi ada juga prinsip titrasi nitrimetri, indikator nitrimetri dan lain-lain. Berikut ini adalah penjelasannya.
Pengertian Titrasi Nitrimetri
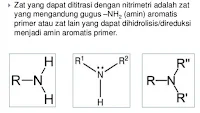
Titrasi nitrimetri adalah titrasi yang digunakan dalam analisis senyawa-senyawa organik, khususnya digunakan dalam persenyawaan amina primer. Penetapan kuantitas zat didasari oleh reaksi antara fenil amina primer (aromatik) dengan nitrium nitrit dalam suasana asam membentuk garam diazonium.
Definisi titrasi nitrimetri yang lain: Titrasi nitrimetri disebut juga dengan metode titrasi diazotasi yakni metode penerapan kadar secara kuantitatif dengan memakai larutan baku natriumm nitrit. Metode titrasi diazotasi ini didasarkan padda reeksi diazotasi yaitu sebuah reaksi antara aminia aromatic primer dan asam asam nitrit dalam keadaan asam membentuk garam diazonium. Nitrimetri merupakan sebuah cara penetapan kadar suatu zat menggunakan larutan nitrit.
Prinsip Titrasi Nitrimetri
Prinsip dasar titrasi nitrimetri / prinsip diazotasi yaitu sebagai berikut ini:
- Pemebentukan garam diazonium beraasal dari gugus amin aromatic primer (gugus nitro aromatic dan amin aromatic sekunder).
- Pemmbentukan senyawa nitrosamine berasal dari amin alifatik sekunder.
- Pembentukan senyawa azidari gugus hidrazida
- Pemasukan gugus nitro yang jarang terjadi dikarenakan nitrasi dengan asam nitrit dalam suasana asam sangat sulit.
Contoh zat yang mempunyai guguss amin aromatic primer yaitu sulfa dan benzokain. Sedangkan yang mempunyai gugus amin alifatis yaitu Na siklamat. Kemudian yang mempunyai gugus hidrazida yaitu INH. Selanjutnya yang mempunyai gugus amin aromatis sekunder yaitu fenasetin dan parasetamol. Lalu yang mempunyai gugus nitroaromatik yaitu kloramfenikol.
Indikator Nitrimetri
Untuk dpaat menentukan titik akhir dari titrasi nitrimetri bisa digunakan indikator titrasi nitrimetri yaitu nitrimetri indikator dalam dan nitrimetri indikator luar, berikut ini penjelasannya.
1. Nitrimetri Indikator Dalam
Nitrimetri indikator dalam adalah indikator yang dipakai dengan cara memasukkan indikator tersebut ke dalam laruan yang akan dititrasi. Contoh titrasi nitrimetri inddikator dalam yaitu tropeolin 00 dan metilen blue (5:3).
2. Nitrimetri Indikator Luar
Usahakan Sulfanilat ke dalam Erlenmeyer terlokalisasi pada satu titik, supaya tidak dibutuhkan banyak ammonia untuk melarutkan setelah asam sulfanilat larut, kemudian larutan diasamkan dengan HCI 25% sampai pH 2, sebab asam nitrit terbentuk pada suasana asam. Setelah itu tambahkan KBr, yang pada titrasi nitrimetri dibutuhkan sebagai katalisator dan stabilisator, penjelasannya berikut ini:
- Katalisator adalah untuk mempercepat reeaksi sebab KBr bisa mengikat NO2 membentuk nitrosobromid, yang dapat mentiadakan reaksi tautometri dari bentuk keto dan langsung membentuk fenol
- Stabilisator adalah untuk mengikat NO2 supaya asam nitrit tidak menguap atau terurai.
Hal-hal yang Diperhatikan dalam Nitrimetri
Terdapat beberapa hal yang perlu diperhatikan dalam nitrimetri diantaranya yaitu sebagai berikut ini:
1. Suhu
Ketika titrasi, suhu harus berkisar 5 hingga 15 derjat celcius. Meskipun sebetulnya pembentukan garam diazonium berlangsung pada suhu yang lebih rendah antara 0 sampai 5 derajat celcius. Dalam temperatur 5 sampai 15 derajat celcius digunakan KBr sebagai stabilisatornya. Titrasi tidak bisa dilakukan pada saat suhu tinggi hal tersebut dikarenakan:
- HNO2 yang terbentuk akan menguap ketika suhu tinggi.
- Garam diazonium yang terbentuk dapat terurai menjadi fenol.
2. Keasaman
Berlangsungnya titrasi ini yaitu pada PH + 2, hal tersebut diperlukan untuk:
- Merubah NaNO2 menjadi HNO2-
- Pembentukan garam diazonium.
3. Kecepatan reaksi
Berlangsungnya reaksi diazotani tergolong lambat sekali, sehingga supaya reaksi bisa sempurna maka titrasi perlu dilakukan secara perlahan-lahan dengan pengocokan secara kuat. Pada awal titrasi frekuensi tetesan kurang lebih 1 ml/ menit. Kemudian saat menjelang titik terakhir menjadi 2 tetes/ menit.
Demikian penjelasan yang bisa kami bagikan kepada anda tentang Pengertian Titrasi nitrimetri. Semoga apa yang kami sampaikan dalam blog temukan pengertian ini dapat dipahami dengan baik dan memberikan manfaat.